La tecnología de "detección" de imágenes in vivo hace que las células "encubiertas" no tengan dónde esconderse
¿Quieres controlar el crecimiento de tumores en ratones desnudos en tiempo real? ¿Quieres saber la ubicación de la colonización celular en ratones? ¿Quieres saber el efecto del tratamiento farmacológico sobre los tumores? en vivo?Esto se puede lograr instalando un rastreador en el celular, lo que permite controlar la ubicación y el número de celdas en cualquier momento. Esta tecnología es una tecnología de "detección" de imágenes in vivo. ¿Qué es entonces la tecnología de imágenes in vivo?
1. ¿Qué es la tecnología de imágenes in vivo?
2. Características de la obtención de imágenes con luciferasa
3. Dirección de aplicación de la obtención de imágenes con luciferasa
4. Intercambio de ejemplos experimentales
5. Preguntas frecuentes
6. Información del producto
7. Respecto a la lectura
1. ¿Qué es la tecnología de imágenes in vivo?
En 1999, el Dr. Weissleder, de la Universidad de Harvard (Estados Unidos), propuso el concepto de imagen molecular, es decir, la utilización de métodos de imagen para realizar investigaciones cualitativas y cuantitativas sobre procesos biológicos in vivo a nivel celular y molecular. La imagen in vivo se basa en la imagen molecular. A través de este sistema de imagen, se pueden observar en animales vivos procesos biológicos como el crecimiento y la metástasis de tumores, el desarrollo de enfermedades infecciosas y la expresión de genes específicos.
In vivo, la obtención de imágenes ópticas de animales vivos adopta principalmente dos tecnologías: bioluminiscencia y fluorescencia. La bioluminiscencia es el gen de la luciferasa para marcar células o ADN, mientras que la tecnología de fluorescencia utiliza genes indicadores fluorescentes como la proteína fluorescente verde y la proteína fluorescente roja y fluorescencia como FITC, Cy5 y Cy7. Elementos y puntos cuánticos (QD) para el etiquetado. La bioluminiscencia de los mamíferos generalmente integra el gen de la luciferasa de la luciérnaga (compuesto por 554 nucleótidos, aproximadamente 50 KD), es decir, el gen de la luciferasa, en el ADN cromosómico de la célula de observación esperada para expresar luciferasa. Luego, cultive una línea celular que pueda expresar luciferasa de manera estable, y cuando las células se dividan, diferencien y transfieran, la luciferasa también continuará expresándose de manera estable. Los genes, las células y los animales vivos pueden etiquetarse con el gen de la luciferasa. La luciferasa es un tipo de enzima que puede catalizar sustratos para producir bioluminiscencia. Las luciferasas de diferentes fuentes tienen sus características y pueden catalizar sustratos para emitir diferentes colores de luz. Entre ellas, la luciferasa de luciérnaga tiene una alta sensibilidad y un amplio rango lineal de 7 a 8 órdenes de magnitud. Se ha convertido en el gen reportero de células de mamíferos más utilizado. El plásmido reportero de luciferasa se transfirió a las células y se agregó su sustrato luciferina para incubar las células. En presencia de ATP, O2, y los iones de magnesio, la luciferasa podría oxidar el sustrato de luciferina para producir una reacción de luz visible. Realice una "instalación de 'rastreador' de una sola vez, y rastree y detecte en cualquier momento". Además de la luciferasa de luciérnaga, a veces se utiliza la luciferasa de renilla. Los sustratos de las dos son diferentes, el sustrato de la primera es D-luciferina y el sustrato de la segunda es coelenterazina. Las longitudes de onda de emisión de luz de las dos son diferentes, el rango de la longitud de onda de luz emitida por la primera es de 540-600 nm, y el rango de la longitud de onda de luz emitida por la segunda es de 460-540 nm. La luz emitida por la primera es más fácil de atravesar los tejidos, mientras que la segunda se metaboliza más rápido en el cuerpo y su especificidad no es tan buena como la primera. Por lo tanto, no la mayoría de los experimentos in vivo utilizan luciferasa de luciérnaga como gen reportero.
Figura 1.Localización de células marcadas con luciferasa
El principio óptico de la bioluminiscencia: la luz se dispersará y absorberá al propagarse en los tejidos de los mamíferos, y los fotones se refractarán al encontrarse con la membrana celular y el citoplasma, y los diferentes tipos de células y tejidos tienen diferentes características de absorción de fotones. La hemoglobina es la principal causa de la absorción de luz visible en el cuerpo y puede absorber la mayor parte de la banda azul-verde de la luz visible. Pero en la banda de luz roja de la luz visible mayor de 600 nm, la absorción de hemoglobina es muy pequeña. Por lo tanto, una gran cantidad de luz puede pasar a través del tejido y la piel para ser detectada en la región rojiza. Al menos se pueden detectar unos cientos de células subcutáneas utilizando la tecnología de imágenes bioluminiscentes de animales vivos. Sin embargo, dependiendo de la profundidad de la fuente de luz en el ratón, el número mínimo de células que se pueden ver varía. En términos generales, por cada aumento de 1 cm, la intensidad luminosa se atenúa 10 veces, y la atenuación es mayor para los tejidos y órganos ricos en sangre, y menor atenuación para los tejidos y órganos adyacentes a los huesos. En el caso de la misma profundidad, la intensidad luminosa detectada tiene una relación lineal significativa con el número de células, y el instrumento puede cuantificar la intensidad de luz detectada para reflejar el número de células.
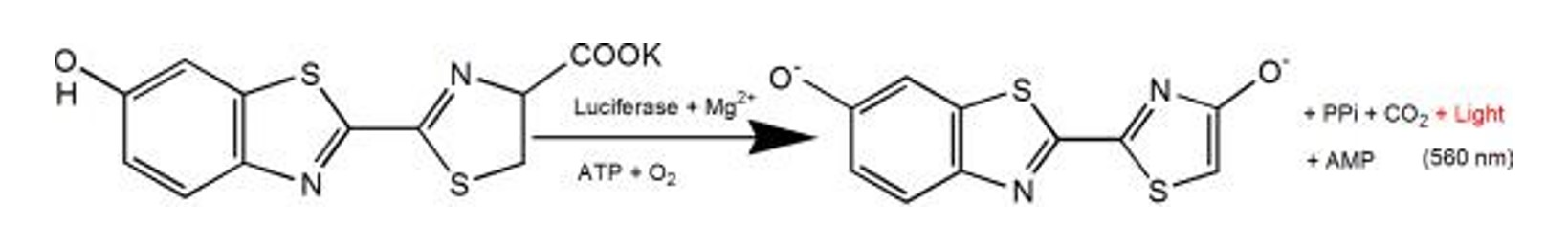
Figura 2. Principio luminiscente de la reacción de la sal de potasio de luciferasa y luciferina
A diferencia de la bioluminiscencia, la tecnología de fluorescencia utiliza genes indicadores fluorescentes o colorantes fluorescentes (incluidos nuevos materiales de nanomarcado como puntos cuánticos fluorescentes) para el marcado. Utilizando la fluorescencia de genes indicadores, proteínas fluorescentes o colorantes, se puede crear una fuente de luz biológica in vivo. La bioluminiscencia es autofluorescencia en animales sin una fuente de luz de excitación, mientras que la fluorescencia requiere excitación por una fuente de luz de excitación externa antes de que pueda ser detectada por el sistema de imágenes. Los marcadores fluorescentes se utilizan ampliamente en animales, células, microorganismos, anticuerpos, fármacos, nanomateriales, etc.
2. Características de la obtención de imágenes con luciferasa
◎ Sin radiación, casi inofensivo para los organismos.
◎ Bioluminiscencia sin fuente de luz de excitación.
◎ Alta sensibilidad, se pueden detectar cientos de células.
◎ Buena penetrabilidad, aún se puede detectar una profundidad de tejido de 3-4 cm.
◎ Alta relación señal-ruido, fuerte señal de fluorescencia y buena antiinterferencia.
3. Dirección de aplicación de la obtención de imágenes con luciferasa
3.1 Crecimiento del tumor
En el experimento de tumorigénesis en ratones desnudos, el crecimiento del tumor se observó en tiempo real sin invasión y no hubo necesidad de extraer el tumor para la medición.
3.2 Medicamentos oncológicos
Se detectó la influencia de la administración sobre el crecimiento del tumor o la metástasis, y el sustrato de fluoresceína pudo eliminarse en 3 horas, sin interferir con el experimento del fármaco.
3.3 Localización celular
Se detectó la localización y distribución de células extrañas en animales.
3.4 Regulación de la expresión genética
El gen objetivo o el promotor del gen objetivo se fusionó con el gen de la luciferasa para detectar cambios en la expresión genética durante el tratamiento farmacológico o el curso de la enfermedad.
3.5 Investigación con células madre
Monitoreo del trasplante, supervivencia y proliferación de células madre; rastreo de la distribución y migración de células madre en vivo.
4. Experiment ejemplo intercambio

Figura 3. en vivo Detección por imágenes del efecto terapéutico del CAR-MUC1 T/CAR-MUC1-IL22 Células T en la formación de tumores mediante inyección subcutánea de células HN4 en ratones[1].
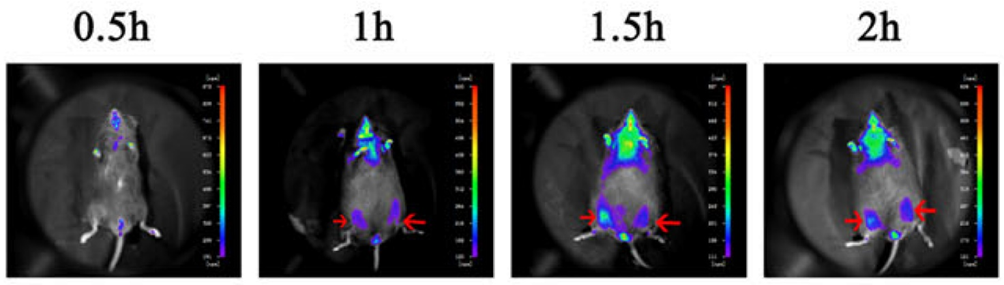
Figura 4. Después de inyectar células HUC-MSC en el músculo esquelético del ratón, se detectó la localización de las células mediante en vivo Imágenes (marcadas con flecha roja)[2].
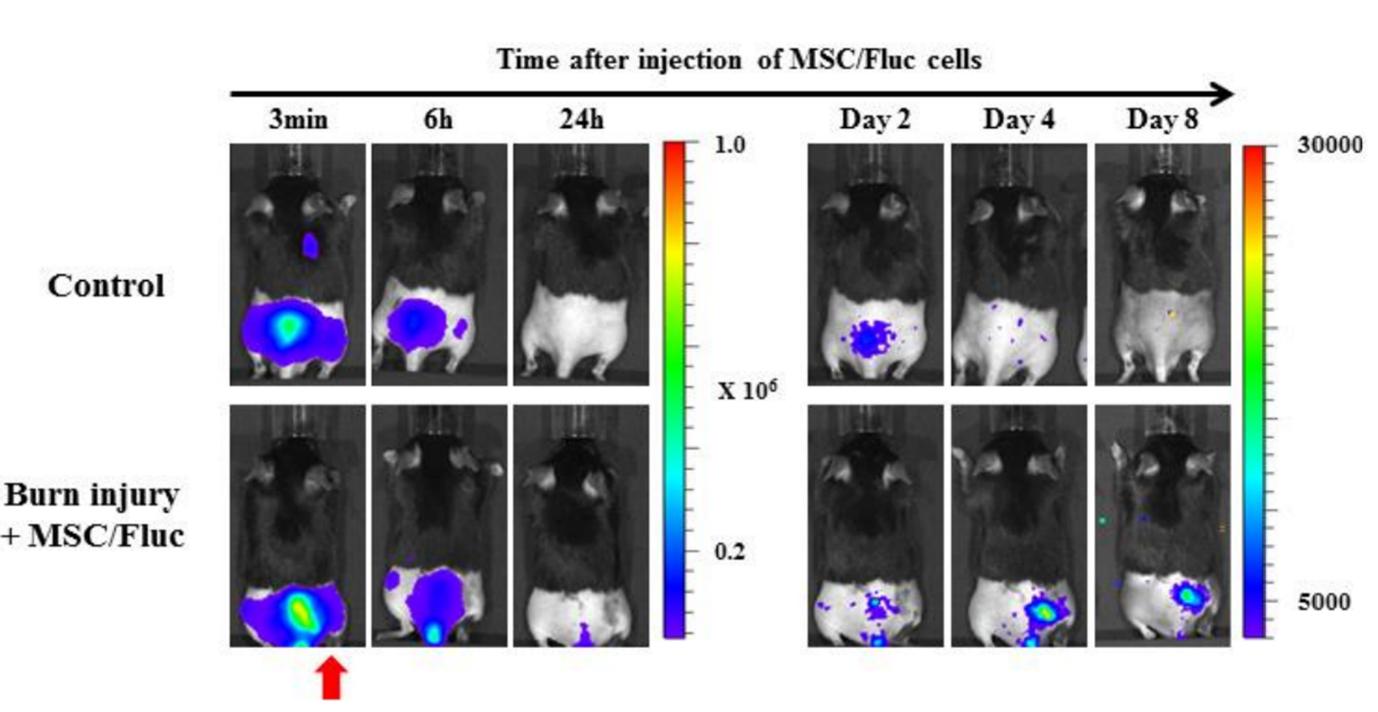
Figura 5. La capacidad de en vivo Imágenes para detectar la migración de células madre mesenquimales (MSC) a las zonas de quemaduras. Se inyectaron células madre mesenquimales (MSC/FLuc) por vía intravenosa en el modelo de quemadura de espalda de ratón. Cuatro días después de la inyección, aparecieron señales de bioluminiscencia en el sitio lesionado de la herida por quemadura y luego disminuyeron gradualmente (la flecha roja indica el sitio de la quemadura).[3].
5. Preguntas frecuentes
P1: En comparación con la tecnología tradicional, ¿cuáles son las ventajas de la tecnología de imágenes por bioluminiscencia?
En comparación con la tecnología tradicional, esta tecnología es más sensible que los métodos tradicionales en la investigación de la metástasis tumoral, la terapia génica, la epidemiología, el rastreo de células madre, la leucemia y otras investigaciones relacionadas. También puede estudiar de forma rápida e intuitiva la patogénesis y la detección de fármacos de enfermedades relacionadas a través de una serie de modelos de enfermedades animales transgénicos.
P2: ¿Cómo etiquetar células madre con el gen de la luciferasa?
Los genes expresados de forma constitutiva pueden marcarse para crear ratones transgénicos y las células madre también. Las células madre hematopoyéticas se extraen de la médula ósea del ratón y se trasplantan a la médula ósea de otro ratón. Esta tecnología puede utilizarse para rastrear la proliferación, diferenciación y migración de las células madre hematopoyéticas en el organismo. Otro método consiste en marcar las células madre con lentivirus.
P3: ¿Cuánto tiempo es apropiado realizar la prueba después de la inyección de fluoresceína y cuánto tiempo puede durar la luminiscencia?
Generalmente, la señal de fluorescencia alcanza el período estable más fuerte después de la inyección intraperitoneal durante 10-15 minutos y comienza a decaer después de 20-30 minutos. Después de 3 horas, la fluoresceína se elimina y la luminiscencia desaparece por completo.
P4: ¿Cómo inyectar fluoresceína en ratones? ¿Cuál es la diferencia entre los métodos de inyección?
La fluoresceína se puede inyectar en ratones por vía intraperitoneal o en la vena de la cola. Puede extenderse a todo el cuerpo de los ratones en aproximadamente 1 minuto. En la mayoría de los casos, la concentración de fluoresceína es de 150 mg/kg. Para ratones de 20 g, se pueden utilizar aproximadamente 3 mg de fluoresceína. En la inyección intraperitoneal, la difusión es lenta, la luminiscencia inicial es lenta y el tiempo de luminiscencia continua es largo. En la inyección de fluoresceína en la vena de la cola, se difunde rápidamente y comienza a emitir luz rápidamente, pero la duración de la luminiscencia es corta.
6.Información del producto
Yeasen es una empresa de biotecnología dedicada a la investigación, desarrollo, producción y venta de tres reactivos biológicos principales: moléculas, proteínas y células. Los productos que ofrece Yeasen son los siguientes.
Tabla 1. Información del producto
| Información del producto | Código del producto | Presupuesto |
| D-luciferina, sal sódica | 40901ES01/02/03/08/10 | 0,1/0,5/1/5/10 gramos |
| D-Luciferina, sal de potasio | 40902ES01/02/03/08 | 0,1/0,5/1/5 gramos |
| D-Luciferina Luciérnaga, Ácido Libre (Preguntar) | 40903ES01/02/03 | 0,1/0,5/1 |
| Coelenterazina h (Preguntar) | 40906ES02/03/08 | 0,5/1/5 mg |
| Coelenterazina h lista para usar (Preguntar) | 40907ES10 | 10 viales |
| Kit de ensayo del gen reportero de luciferasa dual (Preguntar) | 11402ES60/80 | 100/1000 toneladas |
| Kit de ensayo del gen reportero de la luciferasa (Preguntar) | 11401ES60/76/80 | 100/500/1000 toneladas |
| Plásmido reportero de luciferasa VDR (receptor de vitamina D) (Preguntar) | 11502ES03 | 1 μg |
| Plásmido reportero de luciferasa STAT1 (Preguntar) | 11504ES03 | 1 μg |
7. Respecto a la lectura
Una nueva generación de sistemas de detección del gen reportero de la luciferasa: más fácil, más sensible y más preciso
