オルガノイド研究が進むにつれて、参加する人も増えています。この記事では、オルガノイドに関する一般的な知識のポイント[1-5]をまとめ、皆様のお役に立てれば幸いです。
Q: オルガノイドは単一の種類の細胞で構成されていますか、それとも多細胞組織で構成されていますか?
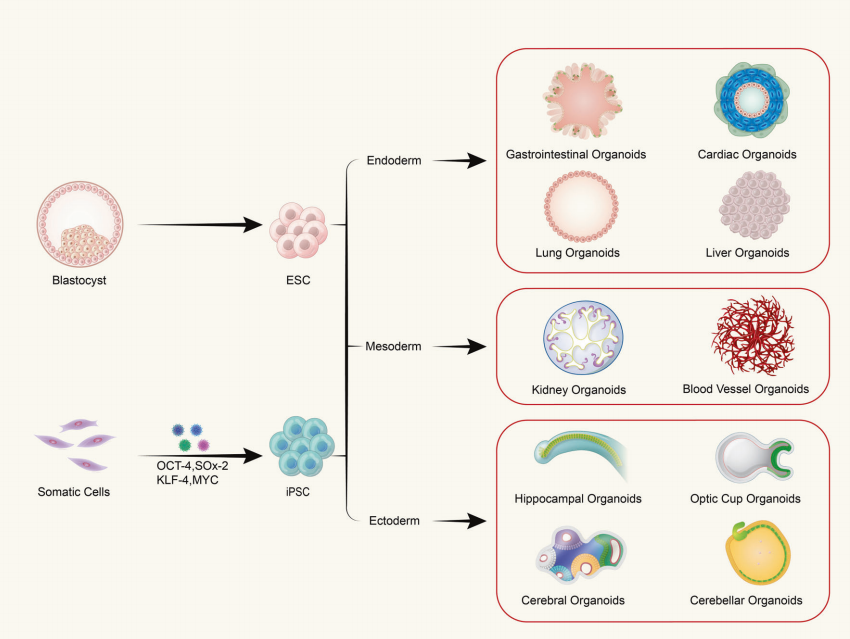
オルガノイドは、成体幹細胞または多能性幹細胞を試験管内で3次元(3D)培養することで形成され、特定の空間構造を持つ組織様構造物となります。オルガノイドは単一細胞からなる構造物ではなく、幹細胞の特性を持つ分化誘導細胞の分裂と分化を誘導することで形成されます。これらの細胞は、生体内の対応する臓器と同様の空間構造、形態、機能を持つ組織へと自己組織化します。
Q: オルガノイドを培養するための原料は何ですか?
(1)多能性幹細胞由来のオルガノイドには、成体幹細胞(ASC)、多能性幹細胞(PSC)、人工多能性幹細胞(iPSC)が含まれます。(2)組織抽出細胞由来のオルガノイドは、腫瘍組織によく見られます。
Q: 新鮮な組織がない場合でも、凍結組織を 3D 培養に使用できますか?
はい、しかし凍結組織のサイズに対する要件が高く、一次凍結組織および細胞の生存率が大幅に低下し、その後の培養の成功率が大幅に低下します。
Q: オルガノイドはどのように凍結され、蘇生されるのですか?
オルガノイドを凍結する最適な時期は、オルガノイドの活性と分化能が最も高まる継代数2~5期です。オルガノイドの蘇生は、細胞蘇生に用いられる方法に従って行うことができます。
Q: 培養オルガノイドのサイズを制御する必要はありますか? また、大きすぎると有利になりますか?
はい、オルガノイドには内部の血管や気液循環系がないため、サイズを制御する必要があります。できれば500μm以内が望ましいです。オルガノイドのサイズが大きいと、中心付近の細胞は外部環境との酸素や栄養の交換に苦労します。そのため、構造が大きくなるほど、死細胞の数が増えます。
Q: マトリックスゲル以外に、オルガノイドの培養に何が使用できますか?
マトリックスゲルに加えて、オルガノイドを培養するための代替手段には、(1)脱細胞外マトリックスおよびその他の派生タンパク質、(2)合成ハイドロゲル、および(3)人工組換えタンパク質ゲルが含まれます。
Q: オルガノイドの指向的分化はどのように達成できるのでしょうか?
オルガノイドにおける幹細胞誘導性分化の初期段階は、複数のシグナル伝達経路によって共同で制御されています。in vitro培養では、これらのシグナル伝達経路の活性を刺激し、細胞を特定の方向へ分化させるために、成長因子の添加が必要です。例えば、Y27632とアクチビンAを用いた誘導により、胚性幹細胞(ESC)または人工多能性幹細胞(iPSC)を胚様体(EB)へと分化させることができます。その後、Wnt3a、FGF-4、ノギンなどの因子によってシグナル伝達経路が制御され、幹細胞を特定の方向へ分化させます。
Q: 臨床サンプルを採取する際に汚染を避けるにはどうすればよいですか?
(1)できる限り無菌サンプリングを確実に行う。 (2)抽出前に、抗生物質を含むPBSに数分間浸漬する。胃、腸、膀胱など、外部環境と接触する可能性のある領域にある腫瘍の場合は、3%〜5%の抗生物質を含むPBSに5〜10分間浸漬することが推奨される。その他の一般的な腫瘍の場合は、1%〜2%の抗生物質を含むPBSに約5分間浸漬する。 (3)細胞抽出中に使用するすべての試薬には、1%の抗生物質と適切な濃度の一次抗生物質が含まれている必要があります。
Q: 腫瘍組織の採取、保存、輸送にはどのような予防措置が必要ですか?
腫瘍細胞含有量の高い腫瘍組織を可能な限り採取し、組織サンプルの空気曝露時間を最小限にすることで汚染の可能性を低減します。採取した腫瘍組織サンプルは、できるだけ早く専用のサンプル保存液を入れた滅菌チューブに移し、低温(4℃程度)で迅速に検査ユニットへ搬送します(採取後2~4時間以内に検査ユニットへ搬送するよう努めます)。
Q: 病変から培養したオルガノイドと隣接組織から培養したオルガノイドには違いがありますか?
腫瘍組織の採取部位にはどのような要件がありますか?はい、違いがあります。腫瘍自体が不均一性を示すため、異なる由来のオルガノイド間で差異が見られることはよくあります。形態学的には、原発巣由来のオルガノイドは、隣接組織由来のオルガノイドと比較して侵襲性の高い構造を示す傾向があり、一般的に不規則な外観を呈します。モデリングや薬剤スクリーニングにおけるエラーを最小限に抑えるため、活性の高い領域から複数のサンプルを採取する必要があります。
Q: 腫瘍オルガノイドの薬剤感受性試験にはどのような種類の薬剤を使用できますか?
臨床現場における抗腫瘍薬の主な種類は、細胞傷害性薬剤(パクリタキセル、シスプラチン/カルボプラチン、5-FUなど)、標的薬剤(EGFR、HER2、VEGFRなどを標的とした薬剤)、免疫チェックポイント阻害剤(PD-1抗体、PD-L1抗体など)に代表される免疫療法薬の3つに分類できます。
Q: PDO栽培の成功率はどのくらいですか?
PDO培養の成功率は、由来によって若干異なります。ほとんどのPDOの成功率は63%~70%、場合によっては90%程度ですが、これは組織自体の活性と大きく相関しています。さらに、臨床治療も成功率に影響を与える可能性があります。組織体外培養の時間と手術手順を短縮することで、成功率を向上させることができます。
Q: 凍結組織はオルガノイドの培養に使用できますか?
一般的に、組織の凍結保存は生存率の大幅な低下を招くため推奨されません。しかし、組織を-80℃で保存した場合、オルガノイド培養に最適な期間は保存後6週間以内です。組織を液体窒素で保存する場合は、保存期間を延長できますが、6ヶ月を超えないことが推奨されます。
Q: 初代培養細胞を抽出すると、線維芽細胞が混ざってしまうことがあります。どのように対処すればよいでしょうか?
(1)線維芽細胞は接着性が低いため、繰り返し接着することで除去できる。 (2)線維芽細胞除去試薬は使用できるが、オルガノイド培養に影響を与えるかどうかは実験的検証が必要である。
Q: 腫瘍オルガノイドの培養には、どれくらいの腫瘍組織が必要ですか?生検サンプルで十分ですか?
一般的に、手術組織は大豆 2 ~ 3 個分の大きさよりも大きくなければなりません。針生検で採取する場合は少なくとも 2 ~ 3 個のサンプルが必要であり、内視鏡生検の場合は少なくとも 6 個以上の腫瘍組織をクランプする必要があります。
Q: 腫瘍組織のサンプルが小さすぎて、その後の検査に必要な培養オルガノイドの数が足りない場合は、どうすればよいですか?
腫瘍由来のオルガノイドは継代後に表現型の違いが現れる可能性があるため、一般的に継代は推奨されません。文献では、オルガノイドの継代は2~3世代、最大5世代に制限することが推奨されています。細胞数が少なすぎて5世代後に試験要件を満たせない場合は、より小型の384ウェルプレートの使用やマイクロ流体チップを用いた試験など、試験方法の変更を検討してください。
Q: 腫瘍組織には正常細胞も含まれるのでしょうか?これらの正常細胞をどのように除去するのでしょうか?
正常細胞が少量存在する可能性があります。まず、採取時に正常組織をサンプリングしないようにしてください。次に、初代細胞を抽出した後、磁気ビーズソーティングまたはフローサイトメトリーを用いてオルガノイドをさらに培養することができます。ごく少量の正常細胞が存在する場合、その後のオルガノイドのモデリングおよび培養に大きな影響を与えないため、除去する必要がない場合があります。
Q: 腫瘍組織から原発細胞を抽出すると、細胞が赤く見えるのはなぜですか?
生体内の組織は血液供給に富んでいるため、赤血球が多く存在します。ほとんどの場合、処理は不要であり、オルガノイド培養にも影響はありません。赤血球が多すぎる場合は、培養前に溶解バッファーで適切に処理することができます。
Q: オルガノイド培養中に黒い粒子が見つかりました。どうすれば除去できますか?
黒い粒子は、不純物または細胞の破片である可能性が高いです。これらは以下の2つの方法で除去できます。
オルガノイドを消化し、培地で繰り返し洗浄して不純物を希釈します。
滅菌済みの外科用メスを使用してオルガノイドを半分に切断し、培地を満たした 1 ml の注射器を使用してオルガノイドから不純物をゆっくりと洗い流します。
Q: オルガノイド培養の継代数に制限はありますか? また、何回継代できますか?
継代数は一般的に、由来細胞の特性に依存します。ほとんどのオルガノイドは、in vitroで最大10回(6ヶ月以上)継代可能です。培養条件の選択も影響を与える可能性があり、一般的に合成因子培地よりも馴化培地の方が優れています。
Q: 腫瘍細胞株 (HepG2 細胞株など) を PDO に培養できますか?
PDO は複雑な自己組織化構造です。単一の細胞株によって形成された 3D 培養システムは PDO と呼ぶことはできず、単に 3D 球状状態と呼ばれます。
Q: オルガノイドを継代するための基準は何ですか?
オルガノイドの発達状況に応じて時間は異なりますが、通常は5~10日で、直径は約100~200μmです。発達が遅いオルガノイドの中には、適切な継代状態に達するまでに数週間かかるものもあります。
Q: 生存可能なオルガノイドの数をどのように数えるのでしょうか?
実験中は、事前に調製したカルセインAM保存溶液を取り出し、カルセインAM溶液を培地に加え、最終濃度0.2μmol/Lとなるように調整します。37℃で60分間インキュベートします。時間経過後、カルセインAMを含む培地をPBSでゆっくりと洗い流し、新しい培地を加えます。励起波長490 nm、蛍光波長515 nmの蛍光顕微鏡を用いて、オルガノイドを観察し、写真撮影します。生存オルガノイドは緑色で、縁が明瞭です。直径20μmを超えるオルガノイドを数えます。
Q: オルガノイドの生存率を計算するにはどうすればいいですか?
オルガノイドの生存率は、X = (Nlive / Ntotal)×100% という式で計算されます。ここで、X はオルガノイドの生存率、Nlive は生存オルガノイドの数、Ntotal はオルガノイドの総数を表します。
Q: オルガノイドを識別する方法は何ですか?
最も基本的な方法は、顕微鏡でオルガノイドの形態を観察し、H&E染色を行うことです。さらに、ウェスタンブロット、qRT-PCR、免疫蛍光、フローサイトメトリーなどの方法を用いて、オルガノイドが対応するバイオマーカーを発現しているかどうかを検出します。遺伝子配列解析により、培養オルガノイドと元の組織との遺伝子の一致を特定できます。一部のオルガノイドについては、特定の機能を有するかどうかを確認するための機能試験を実施できます。例えば、胃オルガノイドは胃酸を分泌できること、心臓オルガノイドは自律的に拍動できることが研究で示されています。
Q: 正常細胞もオルガノイドに成長できますか?腫瘍オルガノイドの培養中に正常オルガノイドを除去するにはどうすればいいですか?
正常細胞もオルガノイドに成長します。正常オルガノイドを除去する方法としては、(1) 顕微鏡下でのHE染色結果に基づく手作業による選別、(2) 培養培地の組成(成長因子/低分子阻害剤など)を調整してPDOを精製する方法、(3) フローサイトメトリーまたは磁気ビーズソーティングのためにPDOを単一細胞に分散させる方法などがあります。
Q: 薬剤感受性実験中、PDO をマトリックスゲルから消化する必要がありますか?
いいえ、PDOは生体内環境をシミュレートするために3次元構造を必要とします。マトリックスゲルによる支持がない場合、薬剤感受性実験の精度に影響が出ます。一般的に、可溶性薬剤はマトリックスゲルを透過してオルガノイドに作用しますが、免疫細胞化学実験を行う際にはマトリックスゲルを除去する必要があります。
Q: PDO 実験は動物モデル (PDX) を完全に置き換えることができますか?
PDO は PDX を部分的に置き換えることはできますが、完全に置き換えることはできません。
Q: 栽培中に PDO が異常に成長し、以前の状態と比べて成長サイクルが短縮し、増殖が急速になる理由は何でしょうか。
外的要因: (1) この異常は、線維芽細胞などの特定の夾雑細胞の急激な増殖によって引き起こされる可能性があります。このような場合は、切片染色と観察を行い、これらの夾雑細胞の存在を確認した上で除去することが推奨されます。(2) 特定の因子や低分子の添加など、培養条件の変化は、PDOの増殖経路をさらに活性化する可能性があります。
内部要因:遺伝子変異の可能性。これを検証するためには、シーケンシングが推奨され、その結果を主要なPDOの結果と比較して、遺伝子変異の有無を判断する必要があります。
Q: PDO の薬剤に対する感受性はどのようにテストできますか?
PDOの薬剤感受性試験は、CCK8アッセイ、ATP細胞生存率アッセイ、生死染色などの方法を用いて行うことができます。腫瘍オルガノイドのATP活性を評価することが最も一般的な方法です。ATPは細胞内で最も重要なエネルギー分子であり、細胞の代謝レベルを測定するために使用でき、生存細胞数を反映することができます。薬剤投与が細胞内ATP含量に及ぼす影響に基づき、解析ソフトウェアを用いて各薬剤レジメンのIC50値(試験対象薬剤の最大阻害濃度の半値)を計算し、腫瘍抑制に最も効果的な薬剤を選択することができます。
Q: PDO の薬剤感受性実験の濃度範囲は原発性腫瘍細胞の濃度範囲と同じですか?
いいえ、同じではありません。通常、PDOの薬剤濃度は初代培養細胞よりも高くする必要があります。正式な薬剤感受性試験に最適な濃度を分析するための予備実験を実施することができます。
Q: 薬物試験にはオルガノイドを成長のどの段階で使用すべきですか?
薬物試験には、一般的に5継代以内のオルガノイドを使用することが推奨されます。この段階では、オルガノイドは最高の安定性と活性を示します。
Q: オルガノイドの確立の成功を判断する基準は何ですか?
(1) 初期予備評価:オルガノイドの形態は、細胞状態から液胞状、出芽状、緻密、または遊離状態へと変化します。(2) 組織切片における分布と類似する特定のバイオマーカー発現の同定。より詳細な比較のために、更なるシークエンシング解析を実施することも可能です。
Q: オルガノイド培養は通常の細胞培養とどう違うのでしょうか?
(1) 細胞培養方法の違い:オルガノイドは三次元構造を維持するために基質や空間構造の支持を必要とするのに対し、通常の細胞培養ではこれを必要としません。(2) オルガノイド培養では、体外分化と自己組織化を達成する必要があり、誘導には様々なサイトカインの組み合わせが必要となり、培養培地の成分が比較的複雑になります。通常の細胞培養では通常、1種類の細胞のみが使用されるため、培養培地の成分は比較的単純です。(3) 細胞源の違い:オルガノイドは多能性上皮細胞に由来しますが、通常の細胞培養は、選択された様々な種類の細胞を培養するのに適しています。
Q: 培養した 3D 球体がオルガノイドであるかどうか、またそれが標的組織と一致しているかどうかをどのように判断すればよいですか?
オルガノイドの同定方法には、H&E染色、免疫組織化学(IHC)、シングルセルシークエンシングなどがあります。標的臓器または組織との一致を判断するには、形態学的、組織病理学的、分子遺伝学的観点から多次元的に判断する必要があります。腫瘍オルガノイドの場合は、特異的なバイオマーカーの検出によって確認することができます。
Q: 培養中に観察されるオルガノイドの形態が文献で報告されているものと異なる場合、その理由は何でしょうか?
第一に、サンプルの供給源やサブタイプには個体差や不均一性が存在する可能性があります。第二に、誘導に用いられる選択されたサイトカインや一部の低分子阻害剤の品質の違いが、異なるオルガノイドの分化形態にばらつきをもたらす可能性があります。文献の記述のみに頼るのではなく、HE染色、IHC、遺伝子配列決定などの方法を用いて、オルガノイドの形態と供給源組織との整合性を確認することをお勧めします。
Q: オルガノイドを用いた薬剤感受性実験を行う場合、薬剤の溶媒として使用される DMSO の量を制御する必要がありますか?
はい、通常、薬剤感受性実験では DMSO の体積パーセントが 0.5% 未満である必要があります。
Q: マトリックスゲルからオルガノイドを回収するにはどうすればよいでしょうか?
以下の方法が推奨されます: (1) 市販のオルガノイド回収溶液 (CAT#41421ES) を使用すると、細胞や細胞表面タンパク質を損傷することなく、穏やかかつ効果的に細胞懸濁液を得ることができます。 (2) マトリックスゲルを低温で解凍して柔らかくし、オルガノイドを放出することができます。
Q: 多くのオルガノイドは回収中に遠心管の壁に付着します。回収率を向上させるにはどうすればよいですか?
回収後に遠心分離する場合は、水平ローター遠心分離機を使用し、遠心速度を適切に上げてください。一般的には、遠心力約300g、回転数約1000~1200rpmが適しています。
製品情報
1)セチュアゲル™マトリックス製品
|
製品タイプ |
カタログ番号 |
製品名 |
マトリゲル カタログ番号 |
応募方法 |
|
基本濃度(8~12 mg/ml) |
40183ES |
356234/ 354234 |
2Dおよび3D培養、浸潤、遊走実験に適応し、in vivo腫瘍形成実験にも使用できます。 |
|
|
40184ES |
356237 |
主に蛍光検出実験などの色検出に使用されます |
||
|
成長因子の減少 |
40185ES |
354230 |
主に成長因子による実験への干渉を排除するために使用されます。成長因子、シグナル伝達経路などの関連研究に応用されます。 |
|
|
40186ES |
356231 |
|||
|
高濃度(≥18mg/ml) |
40187ES |
354248 |
血管新生、ゲル塞栓術、生体内腫瘍形成などの実験に主に使用されます(血管新生の場合、Ceturegel™基底膜マトリックスの最終濃度は10mg/ml以上にすることが推奨されます) |
|
|
40189ES (問い合わせ) |
セチュアゲル™ マトリックス 高濃度、GFR、LDEVフリー |
354263 |
||
|
40188ES |
354262 |
|||
|
幹細胞の場合 |
40190ES |
354277 |
主にhESC、iPSCなどの幹細胞培養に使用されます。 |
|
|
オルガノイド特異的 |
40191ES (問い合わせ) |
Ceturegel™ オルガノイド培養用マトリックス、フェノールレッドフリー、LDEVフリー |
356255 |
オルガノイド培養用Ceturegel™基底膜マトリックス |
2)関連サイトカイン
|
製品名 |
猫 |
サイズ |
| ヒトWnt-3a | 92276ES10 | 10μg |
|
92278ES20 |
20μg |
|
|
92701ES10 |
10μg |
|
| 人間の頭脳 | 92528ES10 | 10μg |
|
91330ES10 |
10μg |
|
|
91306ES10 |
10μg |
|
|
91502ES10 |
10μg |
|
|
91701ES08 |
10μg |
|
|
92602ES60 |
100μg |
|
|
91204ES10 |
10μg |
|
|
90601ES10 |
10μg |
|
|
91113ES10 |
10μg |
|
|
92279ES10 |
10μg |
|
|
92055ES10 |
10μg |
|
|
92053ES10 |
10μg |
|
|
92129ES08 |
5μg |
|
|
91304ES10 |
10μg |
|
|
91702ES10 |
10μg |
|
|
92252ES60 |
100μg |
|
|
90103ES10 |
10μg |
|
|
90104ES10 |
10μg |
|
|
90197ES10 |
10μg |
|
|
90144ES08 |
10μg |
|
|
90196ES10 |
10μg |
|
|
90194ES10 |
10μg |
|
|
90111ES10 |
10μg |
|
|
90120ES10 |
10μg |
|
|
90198ES10 |
10μg |
|
|
91605ES10 |
10μg |
|
|
92251ES10 |
10μg |
|
|
92566ES08 |
5μg |
|
|
92102ES10 |
10μg |
|
|
91103ES10 |
10μg |
|
|
92711ES10 |
10μg |
|
|
92122ES60 |
100μg |
|
|
92201ES60 |
100μg |
|
|
92275ES20 |
20μg |
|
|
ヒトBMP-2 |
92051ES10 |
10μg |
関連資料
参照
1. 笹井 勇、永楽 正、須賀 浩. 三次元におけるin vitro器官形成:自己組織化幹細胞. Dev. 2012;139:4111–21.
2. Lancaster MA, Knoblich JA. 「シャーレにおける器官形成:オルガノイド技術を用いた発達と疾患のモデル化」. Science. 2014;345:1247125. https://doi.org/10.1126/science.1247125.
3. Clevers H. オルガノイドを用いた発生と疾患のモデル化. Cell. 2016;165:1586–97. https://doi.org/10.1016/j.cell.2016.05.082.
4. Kim J, Koo BK, Knoblich JA. 「ヒトオルガノイド:ヒト生物学および医学のためのモデルシステム」Nat Rev Mol Cell Biol. 2020;21:571–84. https://doi.org/10.1038/s41580-020-0259-3.
5. 藤井 正之、佐藤 毅. 体細胞由来オルガノイドを用いたヒト上皮組織および疾患のプロトタイプの構築. Nat Mater. 2020;20:156–69. https://doi. org/10.1038/s41563-020-0754-0.
