當 qPCR 結果異常時該怎麼辦?
qPCR 實驗有時看起來很簡單,有時又很困難。引子設計完成後,像PCR一樣逐步加入qPCR樣品,即可在機台上完成實驗。本文介紹了染料法qPCR實驗中常見的幾個問題,並給出了可能的原因和解決方法,希望可以幫助大家解決qPCR實驗中的困擾。
1.什麼是qPCR?
2. qPCR擴增曲線異常
3. qPCR熔解曲線異常
4. 訂購資訊
5.相關產品
6.關於閱讀
1.什麼是qPCR?
自從聚合酶鍊式反應技術(PCR)發明以來,PCR憑藉其簡單、廉價、可靠、快速、靈敏度高等特點,可能是分子生物學中應用最廣泛的技術。 qPCR是由PCR技術發展出來的技術。在DNA擴增過程中,以螢光染料檢測每個PCR循環後產物總量的方法,不僅具有PCR的快速性、靈敏度高,而且具有特異性強、即時監測、可重複和準確定量等優點。 qPCR是一種利用定量即時PCR擴增設備即qPCR儀,在PCR過程中即時監測核酸擴增產物的技術。 qPCR透過Ct值及標準曲線的分析來實現起始模板的定量分析。 1992年日本人樋口首次提出「即時螢光定量PCR技術」。 1996年美國生物公司推出全球第一台螢光定量PCR儀,該儀器由PCR擴增熱循環系統、螢光檢測光學系統、電腦及應用軟體所組成。透過螢光染料或螢光探針即時監測核酸擴增產物。 ,透過數學函數關係,結合軟體進行結果分析,實現待測樣品初始模板量的計算。因此實時螢光定量PCR技術得到了廣泛的應用。用於qPCR的螢光標記方法分為基於SYBR Green I染料法的螢光染料鑲嵌法、基於Taqman探針法(Cycling Probe、Molecular Bracon等)的螢光探針法、猝滅染料引子法。
qPCR 實驗有時看起來很簡單,有時又很困難。引子設計完成後,像PCR一樣逐步加入qPCR樣品,即可在機台上完成實驗。但要注意很多小細節,例如管壁上不能掛有液體,管內不能有氣泡,要盡量減少管壁、管蓋等的直接接觸,以減少實驗誤差或奇怪的實驗結果。小毅整理了幾個染料法qPCR實驗中常見的問題,並給出了可能的原因和解決方法,希望可以幫助大家解決qPCR實驗中的煩惱。
2. qPCR擴增曲線異常
2.1 擴增曲線對數圖基線期異常
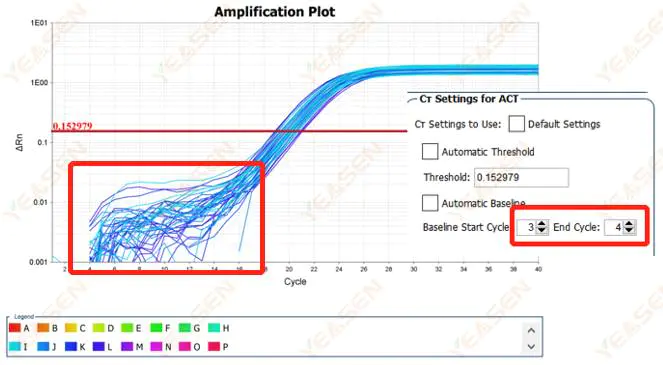
圖 1. 擴增圖
可能的原因:
基線設定不當。
解決方案:
建議增加基線的端點值。調整範例圖如下。

圖 2. 擴增圖
2.2 擴增曲線對數圖曲線分割
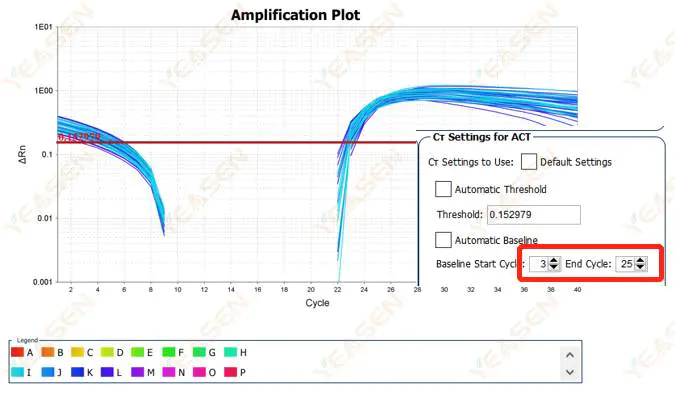
圖 3. 擴增圖
可能的原因:
基線設定得太高。
解決方案:
建議降低基線的端點值。調整範例圖如下。
2.3 擴增曲線線性圖不光滑
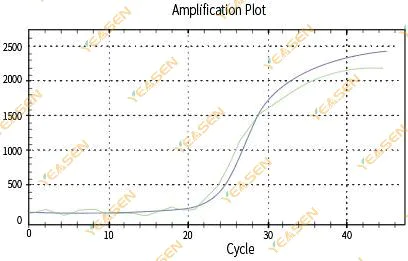
圖 4. 擴增圖
可能的原因:
1)PCR反應管蓋不嚴,反應液洩漏。
2)帶掛壁的PCR反應液。
3)儀器未經過校準(包括自動校準或ROX校準)。
4)體系中抑制劑較多,導致螢光不穩定。
5)儀器過度使用導致螢光收集不穩定。
解決方案:
1)將管蓋壓緊。
2)充分混勻試劑,充分離心後小心放入定量儀中。
3)校準儀器。
4)提高RNA純度,選擇適當的逆轉錄試劑。
2.4 放大曲線線性圖在平台處呈鋸齒狀
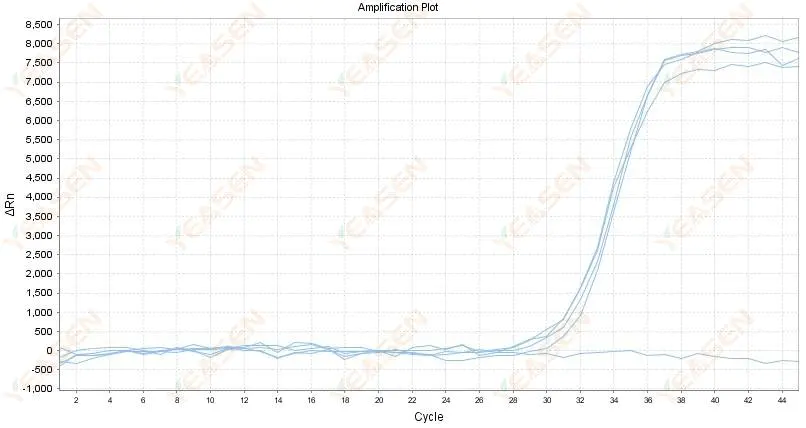
圖 5. 擴增圖
可能的原因:
1) RNA純度差,雜質多。
2) 儀器使用時間過長。
解決方案:
1) 重新提取高品質RNA。
2) 稀釋 RNA 模板以降低雜質的濃度。
3) 校準儀器。
2.5 擴增曲線的線性圖未能達到平台期
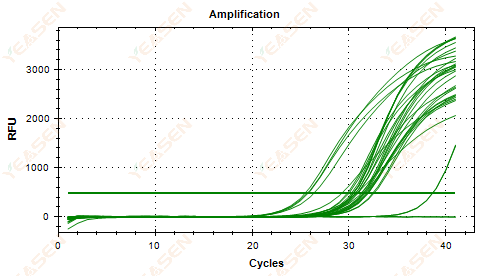
圖 6. 擴增圖
可能的原因:
1) 模板濃度低(Ct值約35)。
2) 擴增循環數太少。
3) 試劑擴增效率低(Ct值小,但也無法達到平台期)。
解決方案:
1) 增加模板的濃度。
2) 增加循環次數。
3) 增加鎂2+ 專注。
2.6 擴增曲線線性圖平台下垂
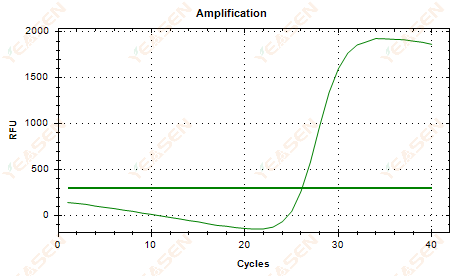
圖 7. 擴增圖
可能的原因:
1) 存在降解(擴增產物降解、SYBR 降解)。
2) 管蓋未蓋好,試劑揮發。
3) cDNA濃度過高(Ct值太小,螢光閾值拉高,下垂較嚴重)。
4) 管內有氣泡,然後它們消失。
解決方案:
1) 提高系統純度。
2) 減少 cDNA 量(稀釋模板)。
3) 降低基線的端點值。
2.7 擴增曲線中Ct值過大
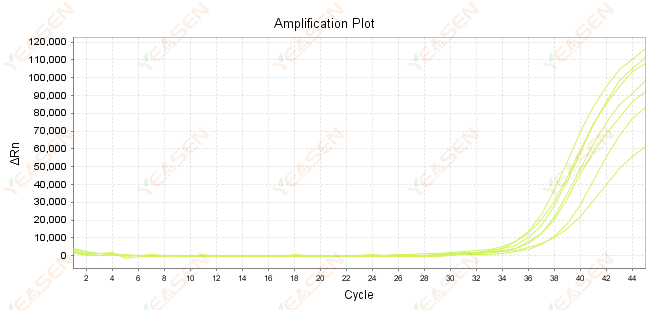
圖 8. 擴增圖
可能的原因:
1) 模板數量少。
2) 擴增效率低。
3) PCR 片段太長。
4) 反應體系中存在抑制劑。
解決方案:
1) 盡量減少稀釋倍數或增加模板量,使Ct值落在15~30之間。
2) 優化反應條件,嘗試三步驟擴增程序,或重新設計引子。
3) PCR產物長度設計在100-150bp內,不建議超過300bp。
4) 複製更高純度的模板。
2.8 擴增曲線重複性差
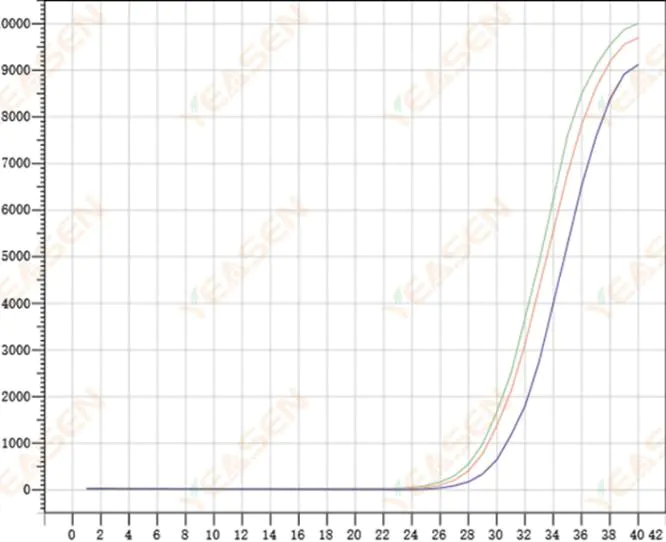
圖 9. 擴增圖
可能的原因:
1) 較大的尖峰誤差。
2) 試劑和系統未充分混合。
3) cDNA 拷貝數低。
4) 沒有使用 Rox 校準。
解決方案:
1) 校準移液管。
2) 充分混合反應體系。
3) 模板濃度低,重複性差,4-6個化合物孔,1-2個偏差較大的數值可以適當丟棄。
4) 最好使用Rox校準。如果所使用的試劑不含Rox,則參考染料需要選擇為None。
2.9 隨機擴增曲線
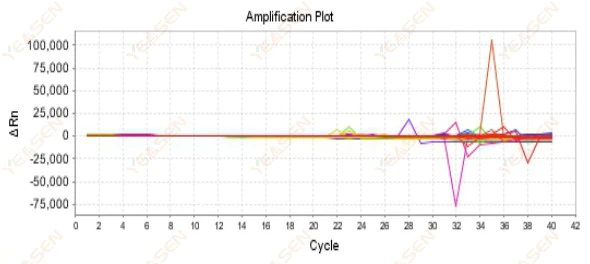
圖 10. 擴增圖
可能的原因:
Rox濃度與模型不符。
解決方案:
將儀器上的參考染料設定從ROX改為NONE,觀察擴增曲線是否恢復正常。
2.10 NTC 峰值
2.10.1 Ct>35,熔融曲線Tm值<80℃
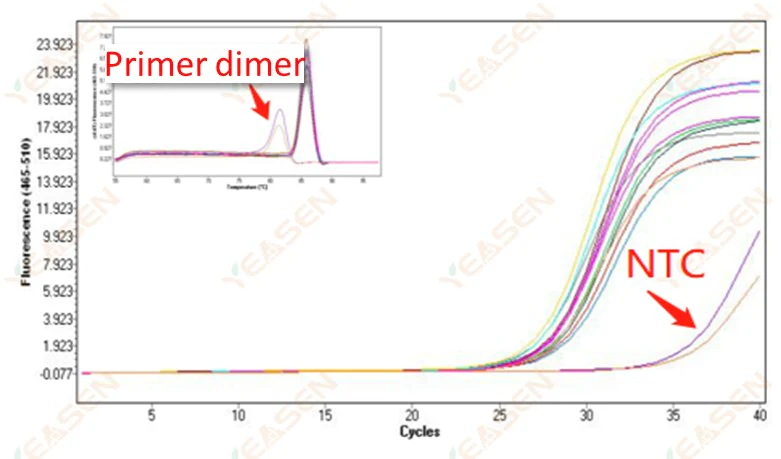
圖 11. 擴增圖
可能的原因:
引子二聚化結果。
解決方案:
優化引子。
2.10.2 Ct值<35,NTC解離曲線與基因解離曲線峰形重疊
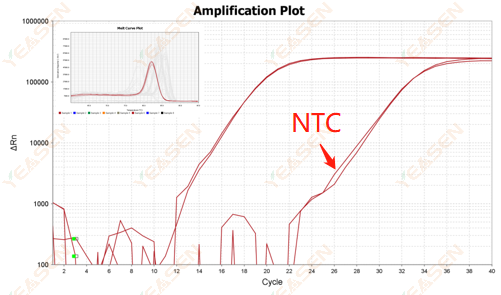
圖 12. 擴增圖
可能的原因:
反應體系污染。
解決方案:
逐一檢查污染源。
3. qPCR熔解曲線異常
3.1 熔解曲線單峰但不尖銳
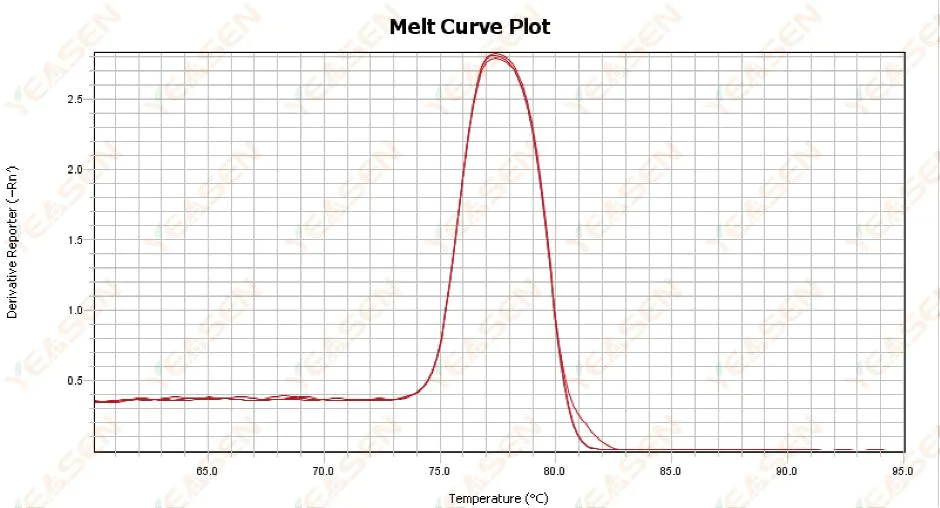
圖 13. 熔解曲線圖
可能的原因:
1) 與試劑成分、儀器型號有關。
2) 存在類似大小的片段的非特異性擴增。
解決方案:
1) 從峰值開始到峰值結束的溫度跨度不高於7°C。結果被認為是可用的,即單峰。
2) 採用高濃度瓊脂糖電泳(如3%瓊脂糖)輔助測定。
3.2 解離曲線呈雙峰狀,下峰Tm在80℃前
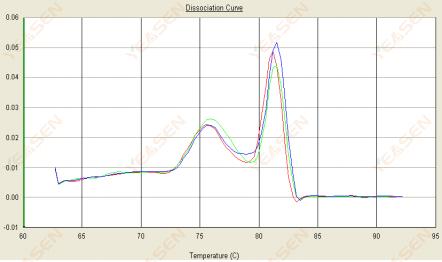
圖 14. 解離曲線
可能的原因:
存在引子二聚體。
解決方案:
增加退火溫度、降低引子濃度或重新設計引子。
3.3 解離曲線呈雙峰狀,下峰Tm在80℃後
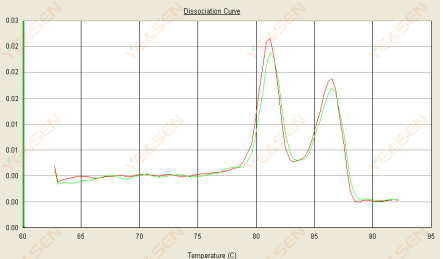
圖 15. 解離曲線
可能的原因:
1) 引子特異性差導致非特異性產物的擴增。
2) gDNA 污染。
解決方案:
1) 檢查引子的特異性,如果較差則重新設計。
2) 經NRC陰性對照確認,如有,需重新製備模板。
3.4 熔解曲線峰雜亂
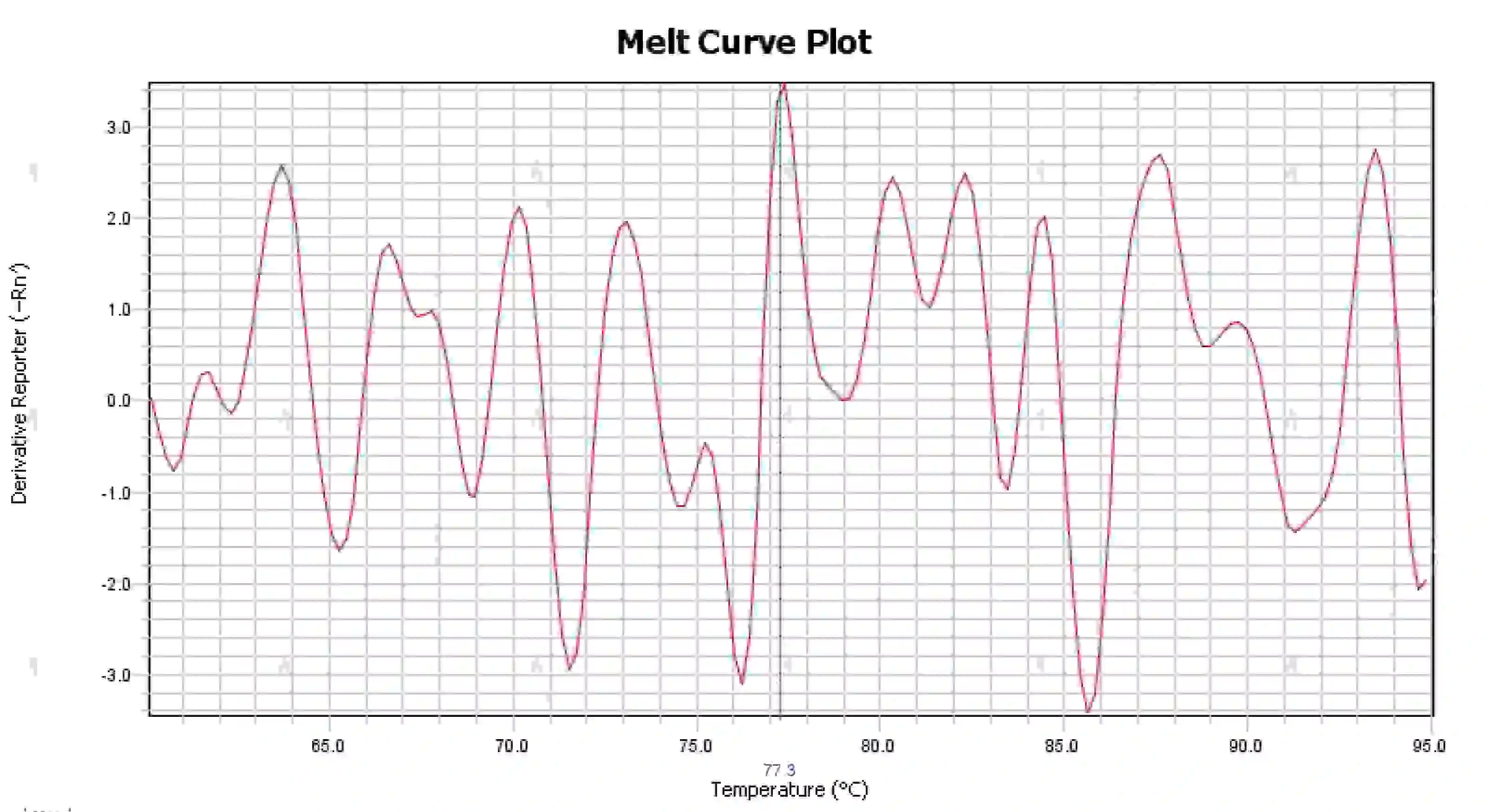
圖 16. 熔解曲線圖
可能的原因:
1) 反應體係受到污染。
2) 試劑暴露在強光或高溫下會導致試劑失效。
3) 儀器長時間未校準。
4) 耗材與儀器不匹配。
解決方案:
1) 結合NTC和NRC結果來確認污染,建議逐一排除水、引子、酵素和環境的污染。
2) 建議與新試劑做比較實驗。
3) 建議定期進行儀器校準維護。
4) 確認相應儀器對耗材的要求。
3.5 熔化曲線前端的假峰
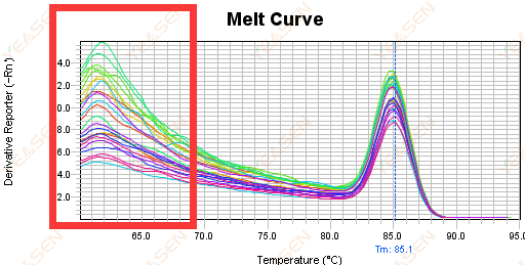
圖 17. 熔解曲線圖
可能的原因:
Rox 濃度與模型不符。
解決方案:
建議取消Rox校正,看看解離曲線是否正常。
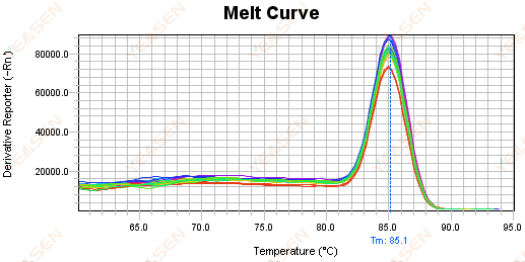
圖 18. 熔解曲線圖
4. 訂購資訊
表 1. 訂購資訊
| 產品名稱 | 產品代碼 | 規格 |
| Hieff Unicon™ Universal Blue qPCR Master Mix(染料基) | 11184ES03 | 1 毫升 |
| 11184ES08 | 5×1 毫升 | |
| 11184ES50 | 50×1毫升 | |
| 11184ES60 | 100×1毫升 |
5.相關產品
提供的產品
表 2. 相關產品
| 產品定位 | 產品名稱 | 產品代碼 |
| 一步法 gDNA 去除與逆轉錄 | Hifair™V 一步法 RT-gDNA 消化 SuperMix 用於 qPCR(詢問) | 11142ES |
| 高靈敏度預混液(含 gDNA 去除步驟) | Hifair™ III 1st Strand cDNA 合成 SuperMix 用於 qPCR(gDNA digester plus) | 11141ES |
| 高靈敏度試劑盒(含 gDNA 去除步驟) | Hifair™ III 第一鏈 cDNA 合成試劑盒 (gDNA digester plus) (詢問) | 11139ES |
| 普通定量Master Mix(探針法) | Hieff™ qPCR TaqMan 探針預混液 (詢問) | 11205ES |
6.關於閱讀
逆轉錄酶選擇指南
